


Las exacerbaciones de asma (ataques o crisis asmática, asma aguda) son episodios caracterizados por un aumento progresivo de los síntomas (dificultad para respirar, sensación de falta de aire, sibilancias, tos y opresión torácica) y un descenso también progresivo de la función pulmonar. documentable y cuantificable a través de pruebas de función respiratoria como volumen espiratorio máximo en el primer segundo (VEF1) o flujo espiratorio máximo (FEM), que representan un cambio de la situación basal del paciente suficiente para requerir modificaciones en el tratamiento habitual 1-3.
Según esta definición los puntos claves para su identificación son el cambio en los síntomas, el cambio en la medicación, sobre todo en la frecuencia y dosis de los aliviantes y los cambios en la función pulmonar respecto a la variación diaria de un paciente específico (Figura 1).
Sí bien la medida de la función pulmonar es el indicador más confiable de la limitación al flujo aéreo, la evaluación de los síntomas es una medida más sensible del inicio de la crisis ya que el incremento de éstos preceden por lo general, al deterioro funcional. Hay que tener en cuenta sin embargo que muchos pacientes cursan con una percepción disminuida de la obstrucción de la vía aérea (principalmente pacientes con asma de larga evolución, antecedentes de asma casi fatal y los varones) por lo que podrían ser incapaces de percibir los cambios en los síntomas lo que nos regresa nuevamente a la necesidad imprescindible de medir objetivamente la función pulmonar para evaluar la gravedad de la crisis, excepto en los niños menores de 6 años .2
Contrario a los que se postulaba hasta hace poco, el cambio en la función pulmonar provocada por la crisis de asma NO es pasajera; los episodios de exacerbación se asocian a una caída aguda de la función pulmonar con un periodo variable de recuperación, pero los pacientes con agudización continúan en riesgo de declive sostenido de la función pulmonar en el tiempo como se demostró recientemente en un bonito trabajo de Wisnivesky y colaboradores6 donde se evaluó el comportamiento de la función pulmonar después de una exacerbación en 150 pacientes mayores de 18 años, comparado un grupo con exacerbación y otro grupo con asma no controlada pero sin exacerbación (controles): Basalmente el grupo de exacerbación tuvo VEF1% más bajos que los controles (66.2% vs 75.%, p=0.04), a la semana del episodio el VEF% mejoró significativamente en el grupo de exacerbación respecto al basal (76.5% vs. 66.2%, p <0.0001), sin embargo, después de la primera semana y hasta el quinto mes de seguimiento el VEF1% cayó significativamente en ambos grupos, con mayor magnitud en el grupo de exacerbación vs. el grupo de control (-12.5% [95% confidence interval [CI]: -16.8, -8.2] vs. -4.1% [95% CI:-10.5, 2.3] y así se mantuvo hasta el final del seguimiento como puede verse en la figura 2; por lo que es necesario intensificar el manejo de estos pacientes para evitar la caída de la función respiratoria.
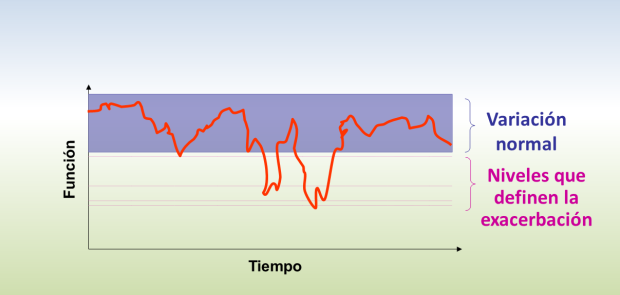
Figura 1: Representación gráfica de una exacerbación en enfermedades obstructivas del pulmón.

Figura 2: Comportamiento de la función pulmonar después de una exacerbación de asma.
La intensidad de la crisis es variable y puede oscilar desde episodios leves que pasan desapercibidos por el paciente hasta otros de extrema gravedad que ponen en riesgo su vida (asma de riesgo vital o casi fatal) o incluso causan la muerte (asma fatal). Se puede presentar en pacientes con diagnóstico ya conocido de asma, incluyendo los pacientes con asma controlada y los de comportamiento leve intermitente; o ser su primera manifestación. Generalmente se presenta en respuesta a la exposición de factores externos (infección viral respiratoria superior, alérgenos inhalados como el polen y esporas de hongos, fármacos como ASA y AINE, alimentos como leche, huevo, aditivos y conservantes, cambios climáticos y contaminación ambiental) y factores endógenos (falta o pobre adherencia al tratamiento, sobre todo a los medicamentos controladores y el estrés emocional)2-3.
La gravedad de la exacerbación determina el tratamiento y, por lo tanto, es esencial hacer una evaluación rápida inicial del paciente con el objetivo de identificar a los pacientes con factores de riesgo vital (Tabla 1), los signos y síntomas de compromiso vital (Tabla 2), y medir de forma objetiva el grado de obstrucción al flujo aéreo mediante la determinación del FEV1 o del FEM y su repercusión en el intercambio gaseoso. La presencia de signos o síntomas de riesgo vital e inminencia de parada cardiorrespiratoria (alteración del sensorio o de la conciencia, bradicardia, hipotensión, cianosis, tórax “silente” o agitación psicomotriz) obligan a considerar la posibilidad de ingreso en la Unidad de Cuidados Intensivos (UCI).
El resto de signos y síntomas de la tabla 2 tienen una utilidad escasa, debido a la correlación pobre con el grado de obstrucción y a la gran variabilidad en su interpretación por lo que la valoración objetiva del grado de obstrucción al flujo aéreo mediante espirometría (FEV1) o con medidor de flujo espiratorio máximo (FEM) permite determinar la gravedad inicial y evaluar la respuesta al tratamiento. En función de los valores obtenidos se considera: exacerbación leve, si el FEV1 o PEF es igual o superior al 70 % de su valor teórico o mejor valor personal previo respectivamente; moderada, si el FEV1 o el PEF están entre el 70 y el 50 %; y grave, si estos valores son inferiores al 50 %. Se estima que la respuesta funcional al tratamiento es satisfactoria cuando el FEV1 o el PEF son superiores al 45 %.
El término ¨estado asmático (status asmaticus)¨está en desuso ya que vagamente hacía referencia a una crisis de asma de gravedad extrema y duración prolongada, en cambio ahora usamos el termino asma de riesgo vital o casi fatal en las crisis definidas por la presencia de al menos un evento de los siguientes: parada cardiorrespiratoria, intubación orotraqueal, necesidad de ventilación mecánica, ingreso a UCI, presencia de hipercapnia (PaCO2 >50mmHg) y/o acidosis (pH < 7,35)3. Se han identificado también los factores que específicamente se asocian con un incremento del riesgo de morir durante la actual crisis asmática y debe ser consignados como tal en el expediente clínico

Basados en las referencias 1-4.
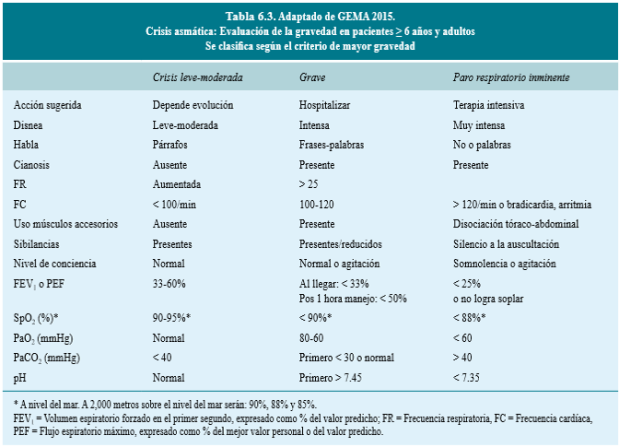
Tabla 2: Evalución de la gravedad de la crisis de asma. Tomado de referencia 3.
En cuanto a la evolución temporal, las crisis asmática se pueden clasificar en dos tipos patogénicos de progresión (Tabla 3); las de instauración lenta (tipo 1) donde predomina como mecanismo patogénico la inflamación de la vía aérea y los pacientes presentan un deterioro clínico y funcional lentamente progresivo, en horas, días o semanas; constituye el 80-90% de todas las crisis que se presentan en urgencias y frecuentemente es desencadenada por infecciones respiratorias altas, mal control de la enfermedad y/o falta de apego al tratamiento. Característicamente los pacientes presentan una respuesta terapéutica lenta y dificultosa. En contraparte, las crisis de instauración rápida (tipo 2) se caracteriza por un inicio abrupto, en menos de 3 horas y el principal mecanismo patogénico es el broncoespasmo disparado por alérgenos inhalados, alergias alimentarias o estrés emocional. Estos pacientes tienen una mayor gravedad inicial, con mayor riesgo de manejo avanzado de la vía aérea, pero la respuesta al tratamiento es rápida y más favorable 4-5.

Epidemiología.
Los episodios recurrentes de exacerbación de asma no son infrecuentes, constituyen la causa más común de consulta en los servicios de urgencias, requiriendo hospitalización el 10-30% de ellas. En Estados Unidos se atienden al año 1.8 millones de episodios en las salas de urgencias (promedio de 8.8 visitas por 100 personas), y causa 4,210 muertes al año, afectando principalmente a niños, mujeres, afroamericanos e hispanos, lo que representa una gran carga social y económica. Las exacerbaciones representan por lo menos el 50% del costo total de la enfermedad .6-8
Hasta un 36% de los pacientes asmáticos pueden experimentar anualmente exacerbaciones y 50% de ellas se presentan en los pacientes con asma persistente leve-moderada. Los riesgo de presentarla se relacionan con el nivel de gravedad clínico y funcional, gravedad de la inflamación eosinofílica basal, insuficiente tratamiento antiinflamatorio preventivo y mal apego a éste, el sexo femenino tiene el doble del riesgo de sufrir exacerbaciones y de hospitalizaciones; además las pacientes con asma grave tienen mayor riesgo de presentar crisis de riesgo vital el primer día de su menstruación 6-8.
Manejo de las crisis de asma.
El manejo de la crisis de asma debe iniciar en casa, el 80% de las crisis de asma se desarrollan en un lapso de 48 horas lo que representa una ventana de oportunidad para actuar tempranamente; por lo que todo paciente debe tener un plan de acción y flujómetro en casa, sobre todo aquellos con factores de riesgo para asma casi fatal y los que tienen baja percepción de los síntomas 9 . Debe iniciarse automanejo o autoajuste del tratamiento ante cualquier empeoramiento de la disnea, sibilancias, tos y opresión torácica, incluso nocturnos, disminución de la tolerancia al ejercicio, interferencia de los síntomas con la actividad cotidiana y disminución mayor al 20% del mejor FEM del paciente 10.
La Global Initiative for Asthma (GINA) sugiere dos estrategias para un plan de acción: 1) Aumento temprano de las dosis de corticoides inhalados (ICS) hasta el doble de la dosis habitual, incluso a dosis máxima, en base a 2,000mcg de diprioponato de beclometasona (DBP) o su equivalente (Tabla 4). 2)Estrategia «SMART» que consiste en que el paciente sea tratado con un aliviador y un controlador en el mismo dispositivo, generalmente un ICS con ß2 agonista de acción prolongada (LABA) de inicio rápido (formoterol); aunque más que un régimen específico, el principal objetivo es educar al paciente para que reconozca tempranamente los datos de descontrol antes de la exacerbación y ajuste tempranamente el tratamiento de mantenimiento ya que esto mejora los resultados, mientras que una intervención tardía se asocia a peor pronóstico, así por ejemplo en una revisión británica de 195 casos de asma fatal entre 2012-2013, casi la mitad (45%) nunca buscaron ayuda médica, el 70% y 80% de niños y adolescentes respectivamente murieron antes de llegar al hospital, sólo el 23% tenían un plan personalizado de acción, 39% abusaron de los ß2 agonista de acción corta (SABA) (más de 12 cartuchos al año) y el 4% usaban más de 50 cartuchos al año 10.
Como se muestra en la figura 3, el tratamiento en casa inicia con el uso de la medicación de rescate, generalmente SABA, con 2-4 inhalaciones vía dispositivo presurizado con dosis controlada (pMDI) o «spray» con espaciador, generalmente aerocámara, cada 20 minutos por una hora, además de alejarse del desencadenante sí lo hubiera. Sí al cabo de la hora los síntomas han resuelto y el FEM es ≥ 80% del mejor valor del paciente (se calcula en base al promedio de 2 mediciones diarias por dos semanas), puede continuar el manejo en casa con SABA cada 4 horas por 24-48 horas y contactar a su médico para decidir sí se aumenta la dosis de ICS o se inicia corticoides orales (CE). En caso contrario, que los síntomas persistan y/o el FEM es <50-80% del mejor valor del paciente, deberá iniciar CE, generalmente a base de prednisona 1mg/Kg, máximo 50 mg, continuar con SABA c/3-4h y buscar atención médica urgente 1,10.Todo paciente con síntomas graves, de instauración rápida, FEM <50% del mejor valor del paciente y/o factores de riesgo para asma casi fatal debe acudir a urgencias inmediatamente.
La combinación de un LABA de acción rápida (formoterol) con dosis bajas de ICS, ya sea beclometosona o budesonida (controlador/aliviador) en un solo dispositivo es efectiva para el control del asma y en pacientes de riesgo reduce las exacerbaciones que requieren CE y hospitalizaciones 1,10. La combinación de formoterol puede tomarse hasta un máximo de 72 mcg/día, lo que corresponde a 6 capsulas de 12mcg o unas 16 inhalaciones con las presentaciones comerciales de inhalador pMDI o inhalador de polvo seco (IPS).
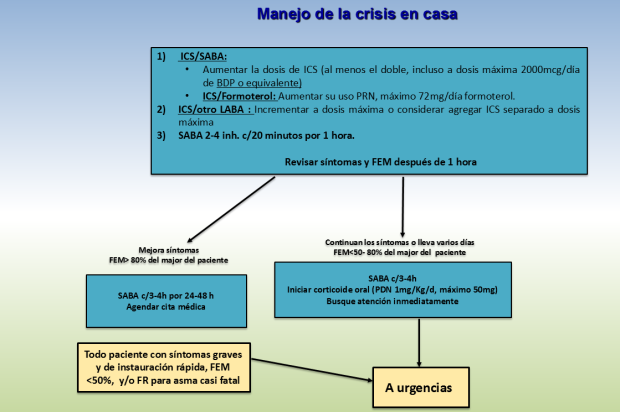
Figura 3: Algoritmo propuesto para automanejo y autoajuste temprano ante crisis de asma. Basado en las referencias 1 y 10.
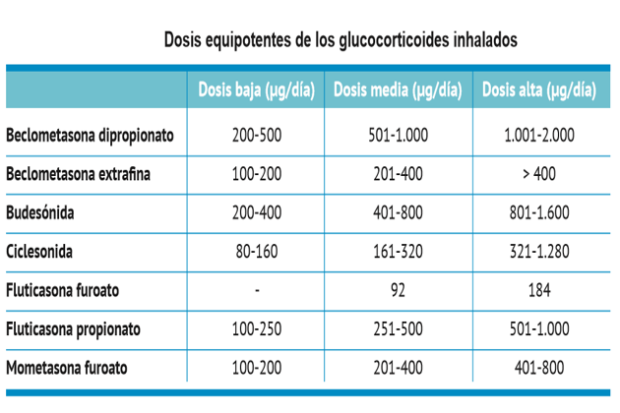
Tabla 4: Equivalencia de ICS. Tomado de referencia 4.e
En el caso que el paciente sea atendido en una unidad de primer nivel (C/S, flilial de EMP) el manejo inicia enfocándonos en confirmar el diagnóstico de asma, considerando los diferenciales (ICC, cetoacidosis diabética, EP, aspiración de cuerpo extraño) a través de una historia clínica y examen físico breve y dirigido a la par que se va instaurando el tratamiento y valorando la gravedad de la crisis de tal manera que solamente las crisis leves-moderadas deberán ser tratadas en este nivel (figura 4). La evaluación debe incluir tiempo de evolución de la exacerbación, probable desencadenante, gravedad de la sintomatología, incluyendo los signos vitales y los signos de exacerbación grave como agitación-somnolencia, habilidad de hablar frases u oraciones completas, uso de músculos accesorios de la respiración; datos de anafilaxia, factores de riesgo para asma casi fatal, medicación actual. Deben considerarse y buscar signos de complicaciones como neumotórax y neumonía y realizar mediciones objetivas como la oximetría de pulso y el FEM desde niños mayores de 5 años. El tratamiento en este nivel se basa en la administración repetida de broncodilatadores de acción rápida, inicio temprano de CE y suplementación de O2 sí está indicado. Para las crisis leve-moderadas la administración de SABA 4-10 inhalaciones cada 20 minutos durante la primera hora es eficaz y eficiente para revertir la limitación al flujo aèreo; es la manera más costoefectiva de administrarlos y además tienen inicio más rápido de acción, mayor disponibilidad del fármaco y menos efectos adversos comparado con la vía nebulizada, sin embargo estos beneficios se pierden en las crisis graves, sobre todo cuando el paciente además está hipoxémico, conviene más administrar los SABAs nebulizados usando como fuente de aire el oxígeno. Después de la primera hora se baja la frecuencia a 4-10 inhalaciones cada 3-4 horas y no serán necesarios dosis adicionales sí hubo buena respuesta (FEM ≥ 60-80% del mejor valor del paciente)1 .
El O2 suplementario está indicado sí la SO2 permanece debajo de 95% (98% en niños menores de 11 años), los CE deben administrarse tempranamente sobre todo sí el paciente ya había incrementado la dosis de los ICS en casa y/o lleva varios días con la crisis. La dosis recomendada es 1mg/Kg/día de PDN o equivalentes, máximo 50mg/día y 1-2mg/Kg/día en niños de 6-11 años, máximo 40mg y deben mantenerse por 5-7 días. Durante el alta (FEM ≥ 60-80% del mejor valor del paciente, SO2 >95% al aire ambiente, condiciones favorables en casa) se debe prescribir el aliviador PRN, ajustar el controlador según convenga, manteniendolo a dosis alta por 2 semanas a 3 meses, revisar la técnica de inhalación, explicar datos de alarma y evitar desencadenantes, citar en 3-5 días para dar seguimiento y establecer un plan de acción.
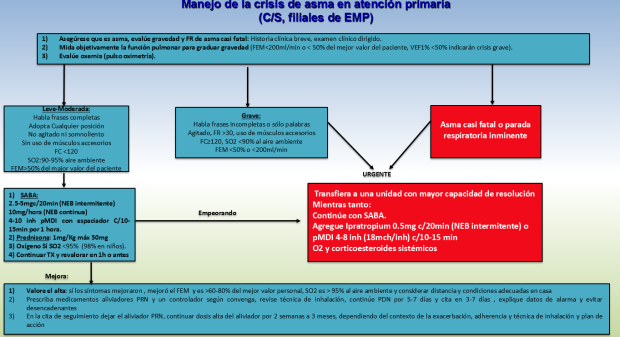
Figura 4: Algoritmo propuesto para manejo de la crisis asmática en atención primaria. Basado en referencias 1 y 3.
En sala de urgencias toca reevaluar al paciente para confirmar que se trata de una exacerbación asmática (Figura 5), considerando siempre los diagnósticos diferenciales y presencia de complicaciones (neumotórax, neumomediastino, atelectasias, neumonía), sin que la realización de exámenes de laboratorio retarden el inicio del tratamiento de urgencia (SABA, CE endovenosos y O2 suplementario) y la valoración de la gravedad, centrándonos sí estamos ante una asma casi fatal o parada respiratoria inminente que amerite manejo avanzado de la vía aérea y su ingreso a Unidad de Cuidados Intensivos (UCI). Todo paciente con signos de paro respiratorio inminente (somnolencia, confusión, agitación, agotamiento), habla entrecortada, pobre esfuerzo respiratorio, silencio respiratorio, presencia de arritmias, hipotensión y cianosis, hipercapnia, acidemia, hipoxemia persistente, FR>30, FC>120 debe ser considerado para intubación y uso de ventilación mecánica invasiva. El uso de ventilación mecánica no invasiva (VMNI) no debe retrasar el manejo avanzado de la vía aérea y sí se llegara a considerar (pacientes con crisis graves sin falla respiratoria ni acidemia) debe vigilarse estrechamente.
Sí la condición del paciente lo permite (crisis leve-moderada o grave sin parada respiratoria inminente ni criterios de asma casi fatal) debe evaluarse de manera objetiva la obstrucción ya que es la medida más certera de la gravedad de la crisis, ya sea con espirometría (VEF1) o con flujómetro (FEM) y monitorizarlos cada hora hasta que se constate buena respuesta al tratamiento; además se puede enviar exámenes de laboratorio para completar la evaluación incluyendo la Rx de tórax sí se sospecha de complicaciones o diagnóstico alternativo o pacientes que no estén respondiendo adecuadamente, BHC, EKG, incluso ecocardiograma.
Debe mantenerse una saturación arriba de 95% y los niveles menores de 92% a pesar de O2 suplementario es indicativo de hospitalización, así como niveles menores de 90% requieren medidas agresivas. A todos los pacientes con VEF1 inicial<50%, que no están respondiendo adecuadamente o en franco deterioro, debe evaluarse con gasometría buscando criterios de falla respiratoria (PaO2<60mmHg o PaCO2>45mmHg a nivel del mar) la cual puede asociarse o no a fatiga y somnolencia y es indicación de manejo avanzado de la vía aérea.
La piedra angular del tratamiento en este nivel sigue soendo los broncodilatadores de acción corta, preferentemente vía dispositivos pMDI + espaciador, aunque se prefiere la vía nebulizada en asma grave y asma casi fatal, de preferencia nebulización continua (mejor función pulmonar y menos hospitalizaciones), pero la evidencia es favorable a la nebulización intermitente, una vez que el paciente se estabilizó y/o se encuentra ya hospitalizado (menos dias de estancia, menos nebulizaciones y menos palpitacipones). Para niños y adultos con exacerbaciones moderadas a graves, la adición de bromuro de ipratropio (un antimuscarínico de acción corta), mejoró significativamente la función pulmonar (VEF1: 0.25 L, 95% CI 0.02 to 0.48; FEM:36.58 L/min, 95% CI 23.07 to 50.09) y redujo el número de ingresos hospitalarios ( (RR 0.72, 95% CI 0.59 to 0.87); en una revisión Cochrane reciente11 . El uso de salbutamol endovenoso en esta circunstancia se encontró con evidencia insuficiente en otra revisión Cochrane, tampoco hay bases suficiente para recomendar adrenalina en asma grave refractaria ni ketamina que puede ser un broncodilatador potente, hace falta más evidencia para recomendar su administración durante una crisis asmática, ni antagonistas de receptores de leucotrienos en las crisis, porque no existe evidencia de su uso en esta situación clínica. En cuanto a la aminofilina, ésta tiene un perfil escaso de eficacia (no es mejor broncodilatador que los medicamentos inhalados) y seguridad (margen muy estrecho con reacciones adversas potencialmente graves, y necesidad de vigilancia estrecha de niveles séricos), además agregarlo a la terapia no mejora los resultados comparado con la terapia inhalada. Sugerimos no usar aminofilina IV; aunque sí existe evidencia de su eficacia en la crisis moderada, falta evidencia acerca de su beneficio en la crisis leve y los posibles efectos adversos son conocidos. No debe emplearse debido a que poseen menor eficacia que el salbutamol como broncodilatador y es menos segura. Datos recientes muestran que el uso de aminofilina en niños con crisis asmática grave en terapia intensiva resultó en un retraso en la mejora de los síntomas.
Por su parte el sulfato de magnesio endovenoso no debe usarse de rutina, se ha visto que reduce la hospitalización cuando se administra en infusión de 2g en 20 minutos en paceinetes con VEF1 inicial <25-30%, adultos y niños que no responden al tratamiento inicial, pacientes que persisten hipoxémicos y niños que npo alcanzan VEF1 60% a la hora del tratamiento12.
Los glucocorticoesteroides sistémicos son el anti-inflamatorio de primera elección. Sin embargo, en crisis leves sólo se usarán:
• Cuando existan síntomas de exacerbación por varios días.
• En aquellos casos con asma crónica moderada-grave que no tienen respuesta al tratamiento con broncodilatador (β2 agonista de acción corta).
• Cuando el paciente ya estaba tomando estos medicamentos de mantenimiento.
• Si el paciente no ha tenido éxito con otras opciones de tratamiento.
• Si existen antecedentes de crisis graves previas que requirieron su uso.
• Si presenta deterioro acelerado o con FEV1 o PEF <60% del valor predicho o del mejor valor personal.
En crisis moderada-graves el uso de glucocorticoides sistémicos acelera la remisión de las exacerbaciones y previene las recaídas. Deben prescribirse de manera precoz, durante la primera hora de haber iniciado el tratamiento, debido a que su efecto comienza después de 4-6 horas de su administración. Se prefiere la administración vía oral por ser efectiva, rápida, menos invasiva y más económica que la vía IV. En los niños se prefiere la presentación en solución en lugar de las tabletas. Generalmente su administración en ciclos cortos de 5 días es suficiente. La dosis óptima de CE sistémico no se conoce; GINA 2017 recomienda PDN a 1mg/Kg, máximo 50mg o su equivalente administrada en una sola dosis en la mañana (prednisolona, metilprednisolona, deflexacort) o hidrocortisona 200mg IV dividida en dos dosis.
En cuanto a los ICS a dosis alta en las crisis moderadas-graves, su uso precoz, en la primera hora de la atención, a dosis altas (tres dosis de BUDESONIDA 800 μg nebulizado cada 20 minutos o de FLUTICASONA 500 μg c/10-15 min por pMDI + aerocámara) disminuye las necesidades de ingreso hospitalario de forma similar a la vía sistémica. No existe evidencia para su recomendación en lugar de los sistémicos, pero sumados a estos muestran una reducción del número de ingresos, según un metaanálisis de Cochrane13.
No se recomienda el uso de heliox fuera del contexto experimental en estudios clínicos. aunque un metaanálisis publicado después de la publicacioón de las GINA 2017 mostró que en pacientes con crisis asmática grave (adultos y niños), heliox 70:30 redujo significativamente las hospitalizaciones y el puntaje de gravedad.
En la tabla 5 se resumen dosis de los fármacos usados en la crisis de asma moderada a grave en urgencias.
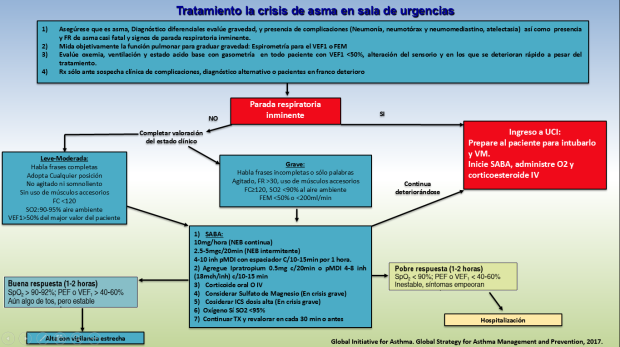
Figura 5: Algotitmo propuesto para el manejo de la crisis asmática en urgencias. Basado en referencias 1, 2, 3, 4 y 10.
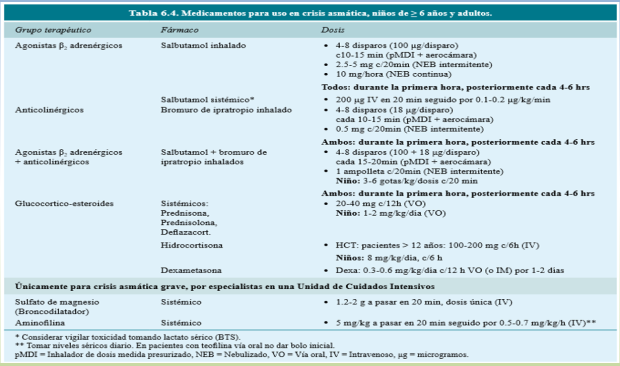
Tabla 5. Tomado de referencia 3.
Los criterios de ingreso hospitalario incluyen (Figura 6): VEF1 o FEM <25% del predicho al ingreso, antes del tratamiento y VEF1 o FEM <40% post-tratamiento. Sí el VEF1 o FEM está entre 40-60% del predicho pero además hay factores de riesgo (persistencia de la sintomatología, inaccesibilidad, problemas psicológicos o aprendizaje, antecedentes de asma casi fatal, presentación nocturna de la crisis, mal control a pesar de uso de CEy embarazo).
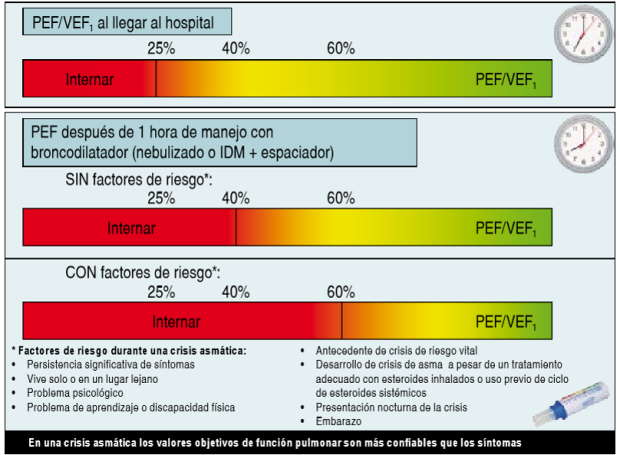
Figura 6: Criterios de hospitalización en una crisis asmática. Tomado de referencia 3.
Después de un alta de urgencias/hospitalización por crisis asmática la vigilancia estrecha incluye, mejorar el control del asma tanto farmacológico (mínimo debe iniciar en paso 3) así como mejorar la adherencia al tratamiento y la técnica de inhalación, además de instaurar un plan escrito de acción. Debe agendarse cita dentro de una semana posterior al alta y por varias semanas hasta que se alcance buen control y la mejor función pulmar individual posible, Todos deben incluirse en programas educativos sí están disponibles, que permitan revisar la comprensión de las causas de exacerbación, factores de riesgo modificables (tabaquismo), propósito del uso corrwcto de los medicamentos, y de las acciones del plan de acción.
El manejo hospitalario de la crisis asmática (Figura 7) se centra en continuar con tratamiento agresivo y monitorización estrecha del paciente, pues la broncoconstricción, la inflamación de la vía aérea, la hipersecreción de moco, pueden provocar la instauración rápida de insuficiencia respiratoria en cuyo se debe detectar a tiempo y transferirlos de manera temprana a UCI10-14.
La mayoría de los pacientes hospitalizados por asma, responden a la terapia médica, pero un 10-63% pueden desarrollar hipoventilación (hipercapnia), lo que traduce la presencia de obstrucción grave al flujo aéreo y es una manifestación de fatiga muscular, aunque no es una indicación absoluta de ventilación mecánica por sí sola, debe alertar a implementar medidas más agresivas. La acidosis láctica es frecuente en el asma aguda y parece ser más bien un efecto directo del uso de los ß2-agonistas en el metabolismo celular que por hipoxia ya que su incidencia y magnitud se correlacionan con los niveles séricos de estos fármacos. Su presencia no se asocia con peor pronóstico pero la acidemia misma puede empeorar la disnea aunque la obstrucción haya mejorado (lo que puede determinarse con las pruebas de función respiratoria o la monitorización de la resistencia sí el paciente está ventilado) y permitirnos bajar la dosis. Otro efecto adverso a tener en cuenta y vigilar es la hipokalemia inducida por estos fármacos que pueden predisponer a arritmias10-14.
Aproximadamente 2%-4% de los pacientes hospitalizados por una exacerbación aguda de asma requerirán soporte ventilatorio debido a la falla respiratoria grave, la cual es producida por extensos tapones mucosos que ocluyen la vía aérea (hasta el 58% de los pacientes tienen tapones mucosos en la TAC de tórax en al menos un segmento), aumentan la resistencia de la misma, incrementan el trabajo respiratorio, interfieren con la ventilación y el intercambio gaseoso. Además la broncoconstricción y edema de la vía aérea contribuyen a la limitación del flujo lo que en conjunto causan una incapacidad para vaciar totalmente el pulmón durante la espiración, con el atrapamiento de aire progresivo y la hiperinsuflación que aumenta aún mas el trabajo respiratorio y aumentan la presión intratorácica que contribuye al colapso cardiovascular y la muerte (Figura 8).
La VMNI, como estrategia para tratar la falla respiratoria durante las crisis graves de asma tiene evidencia débil de su eficacia, limitada a una minoría de pacientes muy seleccionados y estrechamente vigilados como por ejemplo pacientes hipercápnicos con trabajo respiratorio incrementado a pesar de la terapia inhalatoria y CE sistémicos agresivos, pero sin alteración del sensorio, acidemia grave, inestabilidad cardiovascular, vómitos y mal manejo de secreciones; además requieren vigilancia estrecha y sí en los primeros 15 minutos de instaurada hay datos de falla terapéutica (continua polipneico, con mucho trabajo respiratorio sin mejoría de la acidemia o empeoramiento y con mayor fatiga) no debe retratarse la intubación y la implementación de ventilación mecánica invasiva (VMI). El objetivo a corto plazo es evitar la intubación y acelerar la respuesta al tratamiento, pero no se ha demostrado que influya en disminuir la mortalidad ni acortar los días de estancia hospitalaria, incluso en la UCI. Hasta ahora los estudios que han evaluado esta estrategia son pequeños, muy variables en sus diseños y mediciones, aunque la tendencia es que se obtienen mejores resultados en pacientes con asma grave que fueron tratados con VMNI (disminución del requerimiento de intubación y uso de VMI en asma casi fatal, igual efectividad que VMI para disminuir PaCO2) lo que sugiere que en ausencia de contraindicaciones VMNI podría ser adecuada en pacientes seleccionados con asma grave que requieren VM14-15 .
Una vez que se ha tomado la decisión de intubar, ésta debe hacerse siguiendo un protocolo seguro, con adecuada pre oxigenación, y un plan de acción para manejo de la vía aérea difícil. Hay consenso que debe practicarse la intubación orotraqueal con una inducción anestésica y parálisis en secuencia rápida ya que tiene una alta tasa de éxito en situaciones de emergencia y minimiza el riesgo de aspiración. Puesto que nos enfrentamos a una situación de presión intratorácica aumentada (hiperinsuflación), debe preverse el desarrollo de hipotensión sobre todo desencadenada por los efectos simpaticolíticos, vasodilatadores, supresores miocárdicos de los anestésicos usados en la inducción anestésica, corrigiendo cualquier grado de deshidratación y teniendo lista las infusiones de vasopresores. Hay varias opciones para inducir la anestesia al momento de intubar, ketamina tendría una ventaja teórica dado su efecto broncodilatador y que no se asocia a hipotensión, pero puede provocar hipersecreción, hipertensión por lo que estaría contraindicada en la enfermedad cardíaca isquémica, además puede provocar hipertensión endocraneal. El propofol tiene la ventaja de una cinética rápida de inicio y termino, algún efecto broncodilatador, pero la inducción de hipotensión limita su efecto. Etomidato tiene pocos efectos hemodinámicos siendo una alternativa ante pacientes hipotensos y una dosis única es improbable que provoque supresión adrenal (su principal efecto adverso), Las benzodiacepinas logran una rápida inducción de anestesia, pero se requieren dosis altas y frecuentemente se asocian con hipotensión. Se deben evitar los opioides debido a que provocan liberación de histamina y broncoconstricción, aunque son deseables en pacientes con disfunción miocárdica avanzada e hipertensión endocraneal donde debe evitarse el efecto simpático del dolor durante la intubación10-15.
La parálisis muscular simultánea a la inducción de la anestesia es indispensable en la intubación de secuencia rápida ya que ayuda a mejorara la visualización de la glotis y la habilidad para intubar. Succinilcolina tiene un rápido inicio y corta duración de su efecto aunque tiene la capacidad de subir los niveles de potasio, predispone a arritmias y libera histamina empeorando el broncoespasmo, por lo que ha sido desplazada por los agentes no despolarizantes (vecuronio, rocuronio), que son de efecto prolongado y podrían empeorar la hipoxemia si no se intuba rápido.
La programación de los parámetros del ventilador es otro gran reto cuando se ventilan pacientes obstructivos en general, sobre todo con gran resistencia en la vía aérea como pacientes con asma aguda grave. Hay dos conceptos fundamentales para el manejo ventilatorio de este tipo de pacientes que influyen la escogencia del modo ventilatorio: 1) El tiempo espiratorio del paciente es muy corto para permitir la espiración completa lo que conduce a hiperinsuflación; la cual a su vez se asocia a hipotensión, barotrauma y neumotórax. Para tratar este transtorno se prefieren las modalidades de volumen control ya que se mantiene constante y garantizado el volumen programado, contrario a lo que pasa con las modalidades de presión que entregan volumen variable en dependencia de la resistencia de la vía aérea (obstrucción), también se recomienda brindar una ventilación minuto (VM) baja, generalmente, ≤10L/min a expensas de disminuir la frecuencia respiratoria (10-14 por minuto), prolongar lo más posible el tiempo espiratorio y ofrecer suficiente PEEP. Siempre debe monitorizarse el auto-PEEP generado (medido automáticamente por el ventilador, después de una pausa espiratoria) y mantenerlo ≤10cmH2O 2) Ofrecer en todo momento ventilación protectora con volúmenes tidales (Vt) los más bajos posibles, lo que en asma debe balancearse para mantener adecuada VM, por lo que se proponen Vt intermedios ≤8ml/Kg de peso ideal para evitar volutrauma y mantener presión de meseta (Ppl) ≤30cmH20 para evitar el barotraumas. Durante la ventilación mecánica invasiva debe procurarse sedación adecuada para evitar el disconfort del tubo y las asincronias, las cuales deben ser abordadas y tratadas antes de aumenrtar la sedación, pues hay que pensar en la liberación temprana del paciente al ventilador. Es muy infrecuente que se llega a necesir¿tar sedación profunda incluso parálsis muscular amenos que la hiperinsuflación no pueda manejarse con las estrategias encionadas10-15.
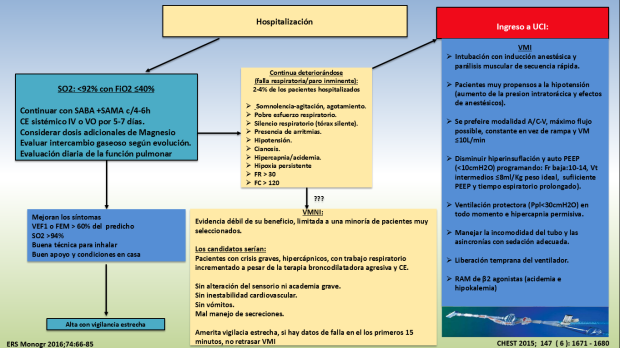
Figura 7: Algoritmo propuesto para el manejo de la crisis aguda de asma grave en hospotalización/UCI. Basados en referencias 10 y 15.
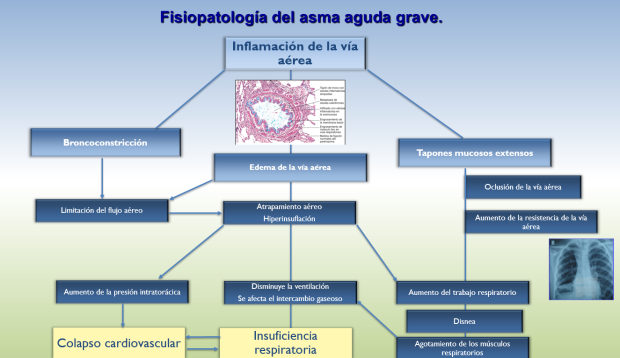
Figura 8: Fisiopatología del asma aguda grave. Basado en referencia 10
Exacerbaciones de asma durante el embarazo.
El asma es probablemente la enfermedad crónica más frecuente en el embarazo y es el trastorno respiratorio que más lo complica. Europa reporta al menos 4% de embarazadas con asma, mientras que EEUU informa tasas del 8% y Australia 12%. Durante el embarazo un tercio de las pacientes reportan mejoría de su asma, pero otro tercio reportan empeoramiento de sus síntomas, sobre todo a partir de las semanas 25-32, sin embargo estudios recientes han evaluado los cambios en la función pulmonar de pacientes con asma de manera objetiva y han encontrado incrementos del flujo espiratorio pico en cada trimestre lo que se ha relacionado con los incrementos de progesterona en la gestación avanzada y broncodilatación inducida por mayores niveles de adenosin monofosfato cíclico (AMPc). También derivado de estudios epidemiológicos se ha encontrado que la gravedad del asma durante el embarazo se relaciona con el estatus del embarazo (complicado o no) y con el uso de tratamiento óptimo para la enfermedad 16
En cuanto a las exacerbaciones de asma durante la gestación, hasta el 20% de las pacientes tiene exacerbaciones que requieren intervención y el 8.5% requieren hospitalización. Aunque pueden ocurrir en cualquier momento de la gestación parecen ser más frecuentes al final del segundo trimestre y es muy raro que ocurran durante el parto, aunque un estudio las reportó hasta en el 46% en asma grave, de hecho las mujeres con asma persistente grave tienen mayor probabilidad de experimentar exacerbaciones, siendo del 8% en mujeres embarazadas con asma leve, 47% en asma moderada y hasta 65% en asma grave 16-18.
Detectar y tratar adecuadamente las exacerbaciones de asma durante el embarazo es muy importante porque los estudios sugieren que la gravedad de la enfermedad se relaciona al riesgo de preclampsia (15% vs 5% en no asmáticas y es más alta, hasta 25%, en usuarias de corticoides orales)16; posiblemente a través de un mecanismo patogénico común: la infiltración de células cebadas (mastocitos) en el músculo liso de los pulmones y el miometrio, además se ha demostrado hiperrecactividad bronquial en preclampsia (se requiere menor dosis para obtener respuesta a metacolina en pacientes con preclampsia sin asma). Por otro lado la asociación de asma-preclampsia se ha descrito en pacientes con régimen de asteroide oral, pero no con inhalados y posiblemente ésta relación sea más bien reflejo de la gravedad del asma que de un efecto farmacológico.
Las agudizaciones de asma son un factor de riesgo para bajo peso al nacer con una magnitud del efecto similar al que provoca el tabaquismo (RR:2.54,IC95% 1.52-4.25). Pero otras asociaciones con malos resultados del embarazo son el parto pretermino y las malformaciones, que han sido reportadas 18.
Para el tratamiento aplican los mismos principios generales, Salbutamol, ICS (beclometasona y budesonida) son seguros, los LABA (salmeterol, formoterol), ipratropio, bloqueadores de receptores de leucotrienos (zarfilukast, montelukast) han resultado ser dañinos en animales con estudios limitados en humanos; en base a esos estudios, las guías recomiendan a salmeterol como el LABA de elección en embarazo.
El uso de CE sistémicos se ha asociado a un leve incremento en malformaciones congénitas, bajo peso al nacer, preclamsia e insuficiencia adrenal en el feto, sin embargo estos riesgos potenciales deben balancearse con el beneficio de su uso durante las exacerbaciones ya que un ataque de asma grave representa más riesgo para el feto que el riesgo potencial de los fármacos (hipoxia). Debe mantenerse una saturación mayor al 95% durante la crisis.
Prevención de las exacerbaciones asmáticas:
La piedra angular de la prevención de las crisis de asma es la medición objetiva del nivel de control habitual, el empleo constante de fármacos preventivos antiinflamatorios y la educación del paciente. Existen medidas farmacológicas efectivas para reducir el riesgo de exacerbaciones:
Uso regular de ICS, sí se asocia a un LABA reduce aún más el riesgo de exacerbación.
Particularmente, la combinación budesonida/formoterol en un solo dispositivo para usarse como controlador y aliviante tiene un efecto benéfico significativo adicional en el riesgo de exacerbación.
Los antagonistas de receptores de leucotrienos también son efectivos en prevenir exacerbaciones (sobre todo en niños).
Omalizumab (anti-Ig E) y mepolizumab (anti-IL5) reduce el riesgo en 40-50% y la termoplastía bronquial también reducen las exacerbaciones.
Dupilumab (anti-IL4 y anti-IL13) reduce las exacerbaciones en un 90%.
Aproximadamente 50% de las exacerbaciones graves de asma son eosinofílicas
Sin embargo, la otra mitad de las exacerbaciones graves de asma se caracterizan por tener una respuesta neutrofílica en la vía aérea por lo que no sabemos la eficacia de las estrategias actuales para prevenir este tipo de crisis19.
Bibliografía consultada.
- Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2017. Avaible from: www.ginasthma.org
- GEMA 4.1. Guía española para el manejo del asma 2016. Disponible en: www.gemasma.com
- Larenas Linnemann y Col. Guía Mexicana de Asma (GUIMA). Neumol Cir Torax, Vol. 76, Suplemento 1, 2017
- Rodrigo G. J. y Col. Guía ALERTA 2. América Latina y España: Recomendaciones para la prevención y el tratamiento de la exacerbación asmática. Arch Bronconeumol 2010;46(Supl 7):2-20
- Sabin B.R, Greenberger P.A. Potentially (near) fatal asthma. Allergy Asthma Proc 33:S44–S46, 2012.
- Jiménez González C.A y Torre Bouscoulet L. Diagnóstico y tratamiento de la crisis asmática en adultos. Neumología y Cirugía de Tórax Vol. 68(S2):S123-S133, 2009.
- Wisnivesky J. P. Impact Of Exacerbations On Lung Function In Patients With Asthma. Am J Respir Crit Care Med 2017;195:A2632.
- Lazarus S. C. Emergency Treatment of Asthma. N Engl J Med 2010;363:755-64.
- Fergeson J. E. et.al. Acute asthma, prognosis and treatment. J Allergy Clin Immunol 2017;139:438-47.
- Bhakta N.R and Lazarus S.C. Acute exacerbations of asthma. ERS Monogr 2016; 74: 66–85.
- Kirkland SW. Combined inhaled beta-agonist and anticholinergic agents for emergency management in adults with asthma (Review). CochraneDatabaseof SystematicReviews 2017, Issue 1. Art. No.: CD001284.
- Rowe BH. Magnesium sulfate for treating exacerbations of acute asthma in the emergency department (Review). CochraneDatabaseof SystematicReviews 2000, Issue 1. Art. No.: CD001490.
- Edmonds ML, Milan SJ, Camargo CA, Jr., Pollack CV, Rowe BH. Early use of inhaled corticosteroids in the emergency department treatment of acute asthma. Cochrane Database Syst Rev 2012;12:CD002308.
- Green E. M. Noninvasive ventilation for acute exacerbation of asthma: A systematic review of the literature. Australian Critical Care xxx(2017)xxx-xxx.
- Leatherman J. Mechanical Ventilation for Severe Asthma. Chest 2015;147(6):1671-80.
- Murphy V.E et.al. Asthma in Pregnancy. Clin Chest Med 32 (2011):93-110.
- Zarqa A; Ulrik C. S. Incidence and risk factor for exacerbations of asthma during pregnancy. Journal of Asthma and Allergy 2013;6:53-60.
-
Stenus B.et.al. Asthma and pregnancy: a prospective study of 198 pregnancies. Thorax 1988;43:12-18.
- O Byrne P. et.al. Therapeutic strategies to reduce asthma exacerbations.J Allergy Clin Immunol 2011;128:257-63.
Correspondencia: Dr. Jorge Iván Miranda, Médico Neumólogo-Internista, egresado del Instituto Nacional de Enfermedades Respiratorias, Ismael Cosío Villegas (INER) México D.F, Teléfono: (505) 27763166, Cell 85122996. Hospital Monte España, Semáforos Villa Fontana, 150 varas al Norte, Managua, Nicaragua. Tel: 22783920-22, ext.: 7025. Correo electrónico: jor30mir@yahoo.com
